鞍旁脑膜瘤综述:分类、诊断、症状及治疗管理
发布时间:2021-12-13 17:19:31 | 阅读:次| 关键词:
- [案例]良性脑瘤预后却“不良”?INC国际四大颅咽管瘤专家:如
- [案例]脑海绵状血管瘤急性出血期的抉择:「回家静养」还是「
- [案例]功能性垂体瘤—泌乳素瘤可以不手术吗?INC国际大咖施罗
- [案例]25岁瘫痪女孩手术全切脑干海绵状血管瘤案例
- [案例]儿童反复头痛、还可能智力下降!脑血管病-烟雾病的“无
- [案例]13岁女孩如何“斗赢”5cm巨大髓母细胞瘤?Rutka教授术后
鞍旁空间(parasellar spaces)特别独特,包括颈内动脉、视神经、动眼神经和三叉神经等较为重要的神经血管结构。脑膜瘤是较常见的肿瘤之一,起源于鞍旁空间。在这个位置,脑膜瘤主要是WHO I级和脑膜上皮亚型的良性肿瘤。应该调查黄体酮(Progestin)的摄入,且大多数引导接受保守策略。如对良性无症状肿瘤,应建议采取观察。肿瘤的生长会导致行手术或放射治疗。对于诊断不确定的且有进袭性模式(aggressive pattern)的,需要进行精确的诊断。对于海绵状窦和Meckel腔的病变,很少考虑完全切除,并带来对内镜鼻内镜或经颅活检的提倡。也有提出可以通过这两种方法进行视神经减压。建议逐例讨论较佳的方法。对大多数病例,经颅手术仍然是必要的。血管损伤可导致严重的并发症。脑脊液漏、脑膜炎、牺牲静脉、视觉障碍和颅神经麻痹是较为常见的并发症。垂体功能障碍在术前评估和术后随访中都很少见,但如果对靠近垂体轴的脑膜瘤,则应进行评估。考虑到经常有肿瘤切除不完全和有延迟复发的风险,需要长期随访。放射外科治疗适用于小的、限制良好的脑膜瘤或海绵窦内术后残留,而放疗(RT)和质子束治疗适用于大的、扩展的、不可手术的脑膜瘤。肽受体放射性核素治疗的位置有待确定。对于少见复发的和进袭性鞍旁脑膜瘤,应考虑靶向治疗。
引言
脑膜瘤是较常见的肿瘤之一,发生于鞍旁空间。海绵窦(CS)和Meckel腔是独特的区域,需要具体的管理。作者对鞍旁脑膜瘤术后并发症的解剖学、流行病学、神经病理学、诊断和治疗、内分泌学评估及随访方式进行了综述。
I.解剖学上的考虑
鞍旁区主要是指蝶鞍的外侧部分,包括海绵窦和Meckel腔(the Meckel’s cave)。鞍旁区域也包括垂体腺体和垂体柄周围的不同区域,但对鞍旁区域的确切定义仍有争议。岩斜区、视神经管和前斜突均属于鞍旁区域。相反,鞍结节(the tuberculum sellae)、蝶轭(the jugum sphenoidale)和斜坡区则不是鞍旁区域的明显的组成部分。鞍旁区域的特异性在于有数量众多的重要的神经血管结构。
海绵窦较早是在公元二世纪由Galien描述的,与角斗士受伤有关。1732年在巴黎,Winslow描述了这个较大的静脉网络,表明它与阴茎的海绵体(corpus cavernosum of the penis)相似。后来的解剖显示,Winslow的解剖描述可能是错误的。Parkinson将海绵状窦描述为大而多变的硬膜外静脉丛(extradural venous plexus),这取决于每一位患者所在的一侧(depending on each patient as each side)Parkinson喜欢使用术语鞍区外侧部分(lateral sellar compartment)。然而,海绵窦(CS)的解剖学描述多年来一直存在争议。Taptas描述了骨膜-硬膜之间的间隙(interperiosteo-dural space)的概念。他将海绵窦(CS)定义为附着在骨头上的颅内骨膜和固有许多皱褶的硬膜之间的一处居所(a lodge between the intracranial periosteum which remained attached to the bone and the dura propria with its many folds)。不同的神经被软脑膜鞘和硬脑膜鞘所覆盖。海绵窦的窦腔(CS sinus)将血液从蝶眶窦眼静脉(the ophthalmic vein the spheno-orbital sinus)、和海绵间窦(the intercavernous sinus)引流出到岩骨窦和颈静脉。对丛与窦(plexus versus sinus)的定义仍存有争议。Kehrli等人总结道,胚胎学和组织学上的海绵窦(CS)的定义与静脉窦是一致的。Kehrli等人观察到海绵窦(CS)的形成是由于大脑胚胎发育和不同的硬膜层所产生的。根据尸体解剖(cadaveric dissection)和MRI研究,他们得出海绵窦(CS)缺乏内侧壁的结论,提出由结缔组织构成了屏障(a barrier constituted of connective tissue)。这些不同的解剖观察有助于海绵窦的手术入路,特别是硬膜外或硬膜间入路。
较重要的血管结构是颈内动脉(ICA),它明显影响内镜入路的抉择。经鼻内镜入路难以到达颈内动脉(ICA)外侧区,存在损伤动眼神经和血管的危险。决定治疗策略较重要的神经结构可能是视觉通路,包括视神经(ON)和视交叉。但海绵窦也包括如动眼(III)、滑车(IV)和外展(VI)神经等不同的眼球运动的神经。三叉神经行径脑池段(goes through its cisternal compartment),然后到达Meckel腔。三叉神经的V1、V2和V3枝分别穿过眶上裂(orbital fissure)、圆孔(the foramenrotundum)和卵圆孔(the foramen ovale.)。
II流行病学和位置的考虑
鞍旁脑膜瘤占全部脑膜瘤的15%。其包含在颅底脑膜瘤中。脑膜瘤的一个重要概念是要准确地确定其起源,这是治疗决定和手术策略的基础。
鞍旁脑膜瘤可根据按不同部位分组进行分类(图1)。
➢海绵窦(CS)
➢Meckel腔
➢海绵窦外侧壁及蝶骨翼内侧
➢前床突
➢岩斜
➢鞍上:鞍结节和鞍膈
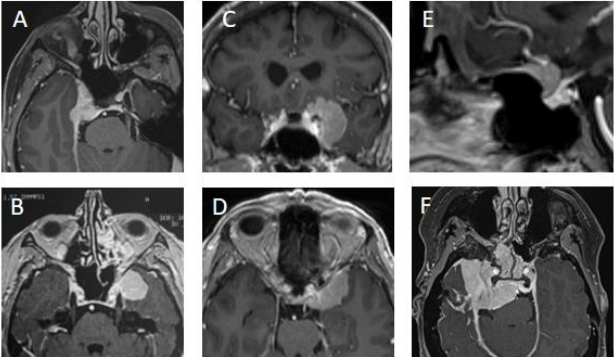
图1:T1加权钆剂增强MRI上的鞍旁脑膜瘤:海绵窦(CS)脑膜瘤延伸至Meckel腔(A),海绵窦侧壁脑膜瘤(B),脑膜瘤起自海绵窦侧壁,延伸至前床突侧壁和上侧面(C),前床突脑膜瘤伴插入的骨瘤(黑色箭头)(D),鞍结节脑膜瘤(E),广泛海绵窦蝶骨岩斜(cavernosphenopetroclival)脑膜瘤(F)。
1.海绵窦
海绵窦内脑膜瘤是一种不同的肿瘤。应仔细分析肿瘤的位置及其与ICA和眼球运动的神经的关系。眼球运动的神经麻痹常显示肿瘤。冒险诊断也很常见。
2.Meckel腔脑膜瘤
这些脑膜瘤单纯位于Meckel腔,并延伸至桥小脑角的内侧。入路较常与海绵窦脑膜瘤不同。症状多为三叉神经感觉减退和神经痛。
3.海绵窦外侧壁及蝶骨翼内侧脑膜瘤
肿瘤延伸穿过或起源自海绵窦外侧壁,可影响颞叶皮质出现水肿、静脉包绕及脑的侵袭。症状可能是癫痫、头痛和神经认知功能障碍,特别是左侧语言障碍。内侧蝶骨翼脑膜瘤的相关症状相似。
4.前床突
前床突脑膜瘤是一种与视神经和颈内动脉(ICA)有关的不同肿瘤。1990年,Al-Mefty博士对它们进行了研究和分类。
I组嵌入位于前床突行经的下侧面(the inferior face)。颈内动脉外膜包绕和附着常导致无法将肿瘤从颈内动脉的外膜剥离,进而无法完全切除。
II组嵌入位于前床突行经的上面和侧面(the superior and lateral face)。蛛网膜层和颈动脉池在颈内动脉(ICA)和肿瘤之间的持续存在通常有助于肿瘤的剥离。
III组嵌入位于前床突行经的内侧面和视神经孔内,常向视神经管内延伸,压迫视神经,有时会有侵袭。在视神经(ON)被包围和受侵袭的情况下,切除肿瘤具有挑战性,并有较高的术后视力受损害的风险。
5岩斜脑膜瘤
一般不认为单纯的岩斜,是属于鞍旁区域的。然而,海绵窦(CS)脑膜瘤可扩展到岩斜区,这是常见的。但它们不应被归类为岩斜区。Kawase等描述了岩斜脑膜瘤的不同模式。扩展于岩斜区的大型海绵窦(CS)脑膜瘤应被命名为海绵窦-岩斜区(caverno-petroclival)或蝶窦-海绵窦-岩斜区(spheno-caverno-petroclival)。与神经、血管形成和入路的关系各不相同。
应明确肿瘤的来源,以确定较佳的策略和较佳的神经外科手术入路。在有Dorello管(颞骨外展神经管)受侵袭时,常发生外展(VI颅)神经麻痹。如果脑池内有大量瘤体,脑干受压可导致眩晕、头晕、平衡、行走障碍和四肢无力等症状。听-面神经受压迫可导致面瘫和听力丧失,因为压迫后组颅神经可导致肿胀改变。脑干水肿间接提示肿瘤的软膜下(pial)血管化,在脑干手术切除时有很高的梗死风险。分泌性脑膜瘤也会引起脑干水肿。
6.鞍上脑膜瘤
鞍上脑膜瘤较常见的症状是视力障碍,与垂体腺瘤相比视力障碍通常是不对称的。与其位置相关,鞍上脑膜瘤通常在诊断时体积适中,在引起神经认知功能障碍前先会压迫视神经。鞍结节脑膜瘤常压迫视神经的上外侧,蝶骨平台的脑膜瘤常压迫视神经的下外侧。文献中提出了不同的鞍结节脑膜瘤分类。较重要的标准是肿瘤的体积、视神经管内的扩展和(颈内动脉ICA和前交通动脉)动脉收包绕情况。
垂体功能障碍少见。高泌乳素血症可能是较常见的生物学异常。关于这一点的文献资料很少。Mortazavi等报道,在经颅入路手术的脑膜瘤队列中,10%的患者术前垂体功能障碍,在内镜入路手术的脑膜瘤队列中,25%的患者术前垂体功能障碍。这种差异可能与肿瘤的位置及与垂体柄的解剖关系有关。
鞍膈脑膜瘤在1995年根据其精确位置被分类。它们也可能会压迫视觉通路。B型和C型中的垂体功能障碍的比率较高,得到诊断的约为40%。
III神经病理学
鞍旁脑膜瘤包括颅底脑膜瘤。在WHO 3级分类和15个亚型中,WHO I级脑膜上皮亚型较常见于鞍旁脑膜瘤。SST2受体通常在脑膜上皮亚型中表达强烈。分泌亚型在这个位置是典型的与较高的瘤周水肿和癫痫发作发生率有关。在Meckel腔和岩斜区也可发现透明细胞脑膜瘤,类似神经鞘瘤,年轻女性多发,具有进袭性(aggressive)模式。突变情况(mutational land)主要包括非NF2突变,如TRAF7、AKT1、SMO、PI3KCA、KLF4和POLR2A。脑膜上皮脑膜瘤很少有2突变(23%),主要是TRAF7、AKT1突变(50%)。
Sahm等人在其表观基因组甲基组分析中定义了不同的DNA甲基化分型(MC):3型属于良性的甲基化分型(MC),2型为过度性(intermediate)甲基化分型(MC),1型为恶性甲基化分型(MC)。它们表明,甲基化分型(MC)比典型的WHO分类与结果更为相关,能更好地鉴别有进袭性的WHO I级和较少进袭性的WHO II级。大多数鞍旁脑膜瘤属于Ben-2甲基化分型(MC),因此预后良好。组蛋白H3K27me3的丢失也被证明有助于复发分层的风险。
大多数海绵窦脑膜瘤不是嵌在骨头上,而是起源于海绵窦内的蛛网膜颗粒,这就解释了为什么脑膜瘤浸润不受蛛网膜鞘保护的颅神经。
IV、鉴别诊断
鞍旁脑膜瘤的鉴别诊断应区分成良性和恶性肿瘤。考虑到良性肿瘤的定义为无生长或缓慢生长,以及影像学上无侵袭性的病变,较常见的鉴别诊断是神经鞘瘤。软骨肉瘤是一种少见的良性演变,很容易与脑膜瘤分化。MRI肿瘤鉴别有时是有挑战性的。奥曲肽生长抑素受体和镓-68 Dotatate PET显像对精确诊断有帮助,但考虑到较初的治疗方法与观察相似,如果进展需要手术或放射外科治疗,上述检查仍是可选的。
对于怀疑为进袭性或恶性肿瘤,治疗方法将根据需要精确诊断的瘤种而改变。脊索瘤、转移瘤、骨髓瘤、淋巴瘤和其他多发性肿瘤更难与脑膜瘤区分,如有疑问,可能需要活检。应仔细分析作为临床症状的患者病史。急性或快速进展,作为强烈的临床症状应在作出诊断时有所警惕。如果全身检查阴性,则需要对肿瘤进行活检。
V诊断时的症状
视野和视力损害是视神经受压较常见的症状。与垂体腺瘤相比,压迫和相关的视觉损害可能是不对称的。使用对视网膜神经纤维层(RNFL)和神经节细胞复合体(GCC)的光学相干断层扫描(OCT)分析视神经纤维被证明比传统的视野和视敏度评估更为敏感,因此应该系统地进行更好的鉴别完全的视觉改变(tight visual alteration)或评估对视神经(ON)纤维损伤的严重程度。
动眼神经麻痹频繁发生,可通过lancaster试验评定。有三叉神经痛、感觉迟钝或感觉减退(hypoesthesia or dysesthesia),应检查角膜反射和颞部肌肉运动功能。面瘫、耳蜗和前庭功能障碍也应得到评估,但通常在很多的桥小脑角病变中会观察到。
肿瘤向外和上方扩展可影响脑功能,诱发癫痫、神经认知功能障碍和失语症。脑干受压迫可产生眩晕、行走和平衡障碍等症状,很少出现四肢麻痹(tetraparesia)。有脑积水或大体积肿瘤可出现颅内高压。脑积水需要首前沿行治疗,通常采用脑室-腹腔分流术(图2)。如果颅内高压与大体积脑膜瘤相关,则需要皮质类固醇、甘露醇和切除肿瘤。
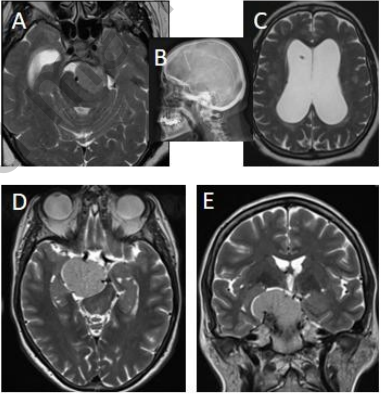
图2:逐个案例的治疗策略:2例临床病例的说明:
病例1:81岁女性,岩斜脑膜瘤导致脑积水。植入脑室-腹腔分流管并对脑膜瘤采取观察。轴位(A)和冠状位(C)T2加权MRI和颅骨x线片(B)。
病例2:D、E:57岁,女性,有无生长、无症状的岩斜脑膜瘤:观察18个月。轴位(D)和冠状位(E)T2加权MRI。
VI术前评估
脑部MRI必不可少。3 Tesla T2冠状位序列对蝶鞍脑膜瘤具有很高的价值,可以精确定位视觉通路(the optic apparatus)(图3)。毫米级CISS或FIESTA序列在识别不同颅神经轨迹(trajectory)方面也很有价值。不同的纤维束示踪成像技术目前正在开发中,可能会在短期内用于临床实践。钆剂增强对描述肿瘤是必要的,除非是孕妇的情况下,未增强的MRI通常被认为足以用于诊断。
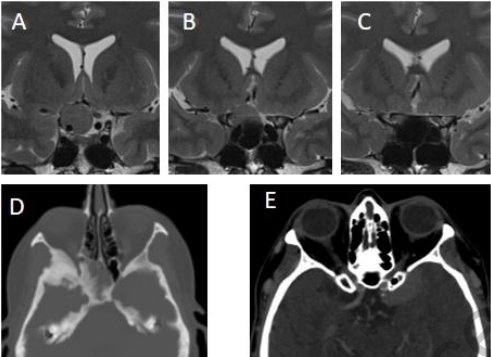
图3:3Tesla T2加权冠状位磁共振(A,B,C)显示鞍结节脑膜瘤与视神经、和视神经管侵袭之间的关系。术前CT显示骨瘤(D),且前床突与不同鼻窦的气化(E)。
术前需要CT扫描评估骨的状态。CT扫描对分析鼻窦和前床突行经也特别有帮助(图3)。如之前的,视力检查应包括使用标准的Goldman视野检查技术的视力、视野检测和OCT评估,其中包括RNFL+GCC(视盘神经纤维层厚度(RNFL)+黄斑区神经节细胞复合体(GCC)及)。VIS(视觉损害评分Visual Impairment Score;德国眼科学会指南guidelines of the German Ophthalmological Society)是一种客观的评分系统,可用于精确评估视力结果和均质化视力结果来比较患者的研究系列。
脑膜瘤很少需要动脉造影和栓塞,适应证依赖于团队。对于鞍旁脑膜瘤,特别是岩斜脑膜瘤,术前栓塞可以限制术中出血,是大体积和复杂的病例。
在临床实践中没有系统地进行内分泌评估,也没有明确的建议,但是文献支持系统和完整的术前评估,特别是在靠近垂体或垂体柄的肿瘤,如垂体移位(dislocation)的情况下。高泌乳素血症可能是较常见的内分泌障碍;垂体功能低下仍然很少见,而在诊断时仍然很少见尿崩症(DI)或抗利尿激素(ADH)分泌异常综合征(SIADH)。
VII诊断性治疗
对良性肿瘤没有任何进袭性(aggressive)或恶性的争论,不需要确定性诊断(diagnostic certainty)。可在出现增长的情况下提出手术切除或立体定向放射外科(SRS)治疗。相反,如果诊断不确定或有进袭性或恶性特征,则建议手术切除。但在不同的如海绵窦(CS)和Meckel腔等位置,完全切除肿瘤通常被认为是不合理的,建议进行活检。图4总结了活检的适应证。活检策略如图5所示。经卵圆孔穿刺活检可以作为Meckel腔和海绵窦后部病变的一种选项,但考虑到细致的入路(delicate approach)和肿瘤样本的体积小,需要神经外科-神经病理学家的专家组合。当经卵圆孔穿刺活检不可行或对Meckel腔或海绵窦后部病变的活检呈阴性时,内镜下鼻内入路对海绵窦前部病变很有意义。应仔细分析颈内动脉(ICA)的行经轨迹。当内镜下鼻内活检被认为是复杂的或有的,经颅硬膜外活检也是一种有价值的选择。经颅微小翼点入路(Transcranial minipterional approach)具有合理的风险,如图6所示。
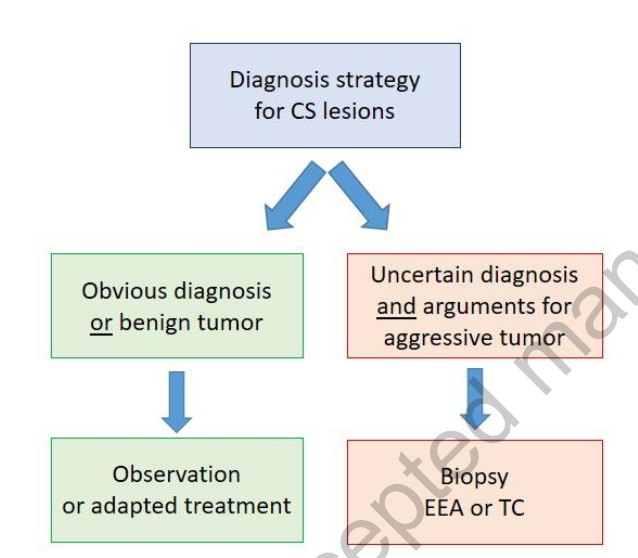
图4:海绵窦病变的活检指征CS:海绵窦;EEA:内镜鼻内入路;TC:经颅入路。
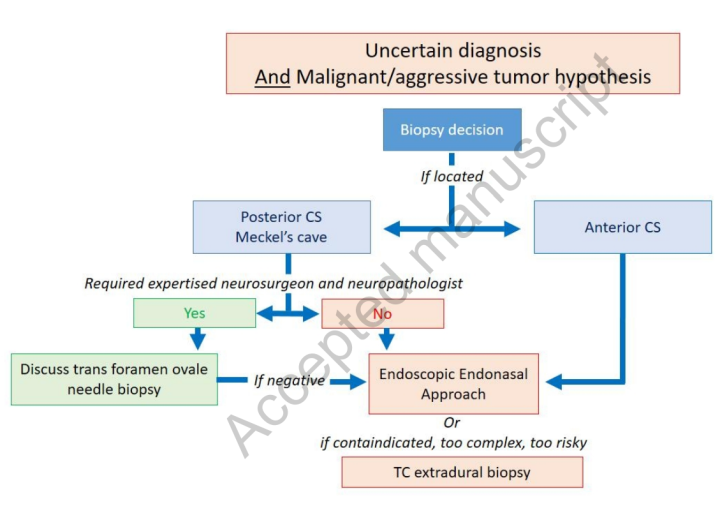
图5:疑似进袭性或恶性的,且诊断不确定的,海绵窦和Meckel腔病变的活检策略。
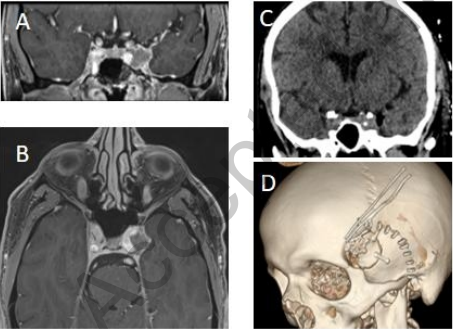
图6:经颅(TC)硬膜外海绵窦(CS)活检:55岁男性,有骨髓瘤病史伴长期缓解。临床表现包括动眼神经麻痹和强烈的眼眶后头痛。怀疑诊断为骨髓瘤、脑膜瘤或神经鞘瘤。经翼点入路经颅海绵窦活检确诊为骨髓瘤。术前T1加权MRI钆剂增强(A,B),术后CT扫描(C)3D骨性重建(D)。
VIII治疗管理
1.概论
海绵窦内和Mecked腔内脑膜瘤被认为大多是无法手术的。Amelot等分析了53例海绵窦(CS)脑膜瘤。中位随访10.8+5.5年。全切偶然发现的患者在随访结束时仍无症状。80%的患者在随访结束时无症状,83%的患者没有出现任何肿瘤生长。本研究显示,即使在动眼神经麻痹的情况下,大多数脑膜瘤也不生长,预后良好,建议在大多数情况下首先采取观察策略。
海绵窦侧壁、蝶骨翼内侧、床突、大的岩斜和鞍上的脑膜瘤大多可以手术,这与其所在位置有关。然而,未生长的和无症状的特征可能引导我们建议观察,即使有动眼肌神经麻痹。
手术仍是脑膜瘤的参照性治疗,但手术风险不应低估。应向患者明确解释手术风险及利益、风险平衡。视神经压迫可能是导致手术的较正式的症状。肿瘤对皮质或脑干的影响也是一种正式的手术指征。
生长和尺寸限制(小到中等)的脑膜瘤可以通过手术或放射外科治疗来治疗(表1)。经典的肿瘤直径≦3cm作为放射外科治疗指征的标准目前已不是较新的;较终的较佳治疗决定应包括肿瘤的位置、与视神经通路和不同的关键结构的接近程度、瘤周水肿程度、一般内科状况、患者年龄和意愿等。SRS治疗对于小的病变的顺利性和合适性较高,且有随肿瘤大小而减小的趋势。Pollock等人通过比较Simpson I级切除的小到中等体积的脑膜瘤,证明了类似的效果。因此,SRS治疗可用于小到中等的、边界局限的且正在生长的脑膜瘤,患者无症状或症状较轻、无视觉通压迫且远离视神经通路。
对于有放射学和/或临床进展的较大且局限性较差(poor-limited)的颅底肿瘤,将提出是放疗的适应证,而不需要任何外科手术或SRS治疗来替代。
2.外科手术入路
a.海绵窦侧壁及床突脑膜瘤入路
进入海绵窦的侧壁通常需要翼点入路。额眶颧入路(Fronto-orbitozygomatic)好转海绵窦的暴露。为了接近肿瘤,需要行海绵窦侧壁去骨术(Dedoubling)。对于海绵窦外侧壁脑膜瘤,通常只切除外生的向外侧扩展的部分。在前床突脑膜瘤中,需要切除床突,以显露颈内动脉(ICA),视神经(ON),并能让肿瘤血行阻断和去插入(devascularization and desinsertion)。如果术前出现视力障碍,一个目标是对视神经(ON)减压。颈内动脉(ICA)是手术过程中的主要问题。为提高手术顺利性,促进肿瘤的切除,建议早期暴露ICA。若出现床突上段的ICA的外膜侵袭(supraclinoid ICA adventitia invasion),则肿瘤切除会不完全。病ICA变或起源于ICA的穿通动脉(perforating arteries)可能导致戏剧性的出血性或缺血性后果(图7)。可以通过EEA(内镜鼻内镜)或TC(经颅)对视神经减压,取决于肿瘤和压迫侧:对视神经(ON)内侧的压缩会倾向于提出EEA(内镜鼻内镜入路),相反外侧压迫会提出伴床突切除的TC(经颅入路)。通常需要对逐个案例进行分析。
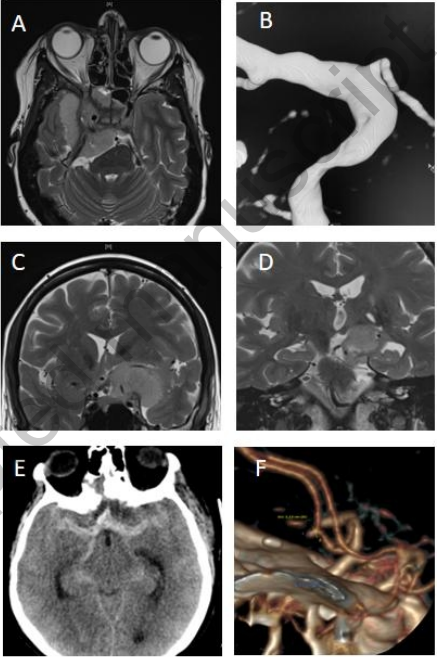
图7:血管手术并发症
病例n°1:视神经减压术中ICA损害;术中修补;术后动脉造影显示ICA壁缺损。行ICA闭塞,出现有利的结果。术前MRI轴位T2加权(A)和使用钆剂增强T1加权(B)与术后3D血管造影(C)。
病例n°2:前床突脑膜瘤伴ICA侵袭,部分肿瘤切除。患者术后出现短暂的偏瘫。结果很快是有利的。MRI显示有限的脑梗塞。术前(D)和术后(E)冠状位T2加权MRI。
病例n°3:脑膜瘤手术中术中出血及脑肿胀.术后CT-扫描显示蛛网膜下腔出血伴大脑前动脉A2段假性动脉瘤。术后CT扫描(E)及3D血管CT扫描。
海绵窦(CS)减压的目的是好转功能结果和避免较激进的手术切除。提出EEA和TC入路,取决于肿瘤的位置,压迫和团队习惯。但对病人的预期益处仍不确定。目前的文献资料还不够丰富,不足以支持目前的临床实践中系统性海绵窦减压。之前描述过经颅(TC)硬膜外入路。较近,鼻内入路被报道在颅神经麻痹(CN)方面提供了有趣的结果,但也不确定对垂体功能的临床相关益处。
b.岩斜和Meckel腔入路
不同的入路可以被提出,也可以联合为前部和/或后部岩椎切除术,乙状窦入路。较好的方法是逐个案例来决定。和对脑干水肿一样,术前应仔细分析,肿瘤的插入、颅神经的轨迹、静脉的外形(venous configuration)、肿瘤体积及扩展情况。
c.鞍结节、扁平及鞍膈脑膜瘤
对鞍结节脑膜瘤的入路的决定仍存在争议。在过去的二十年中,许多方法被描述。经颅入路是历史上一个进行的手术,但较近的进展,为内镜下鼻内手术开辟了新的前景。关于不同的经颅入路,包括经典的翼点入路、匙孔入路、单侧额下入路、眶上入路、半球间入路和内镜下鼻内入路仍有争论,以决定较好的入路。较近的研究倾向于显示经鼻内窥镜入路后视觉效果更好,但相比之下,术后脑脊液漏率和动脉病变率较高(表2)。EEA对于C型膈膜脑膜瘤的不同病例可能是一个有趣的选择。
今天,经颅入路仍然是神经外科学界较合意和较常用的入路。考虑到经颅入路,较佳侧面入路的选择仍存在争议(表3)。较近发展的微创手术导致减少皮肤切口,颞部肌肉收缩和骨瓣大小,建议眉弓或眼睑切口。例如,眉弓入路常用于鞍结节脑膜瘤。但是神经外科医生应该根据病人的美容和发线的插入来调整皮肤切口,同时要注意保持肿瘤和肿瘤和视神经周围的工作角度。经颅内镜辅助手术可以提高肿瘤切除的质量,特别是在鞍结节的盲区,避免与鼻内入路相关的并发症(86)。精确的术前病例分析和逐例判断仍然是必需的。
IX不完全切除的想法(The notion of incomplete removal)
如在1957年Simpson分级所述,完全切除肿瘤包括插入肿瘤(the tumor insertion)可降低复发风险。相比之下,颅底脑膜瘤的不同性明显是常见良性脑膜瘤的特征和完全切除肿瘤的潜在并发症发生率之间的平衡。因此,不完全切除对颅底脑膜瘤来说是常见的,提示增加延迟复发的风险和对长期随访的关注。
X术后颅神经(CN)结果
在术前有视神经压迫和视力损害的情况下,视力好转是常见的,但视力结果明显与术前视力评估的严重程度相关。在肿瘤侵袭视神经的情况下,术后视力损害的风险很高。
手术很少能好转动眼神经麻痹,而术后新的颅神经麻痹在复杂的海绵窦或岩斜脑膜瘤中更为常见。对于在海绵窦内切除脑膜瘤,术后眼球运动功能恶化的风险高。如果是向岩斜延伸的海绵窦脑膜瘤,风险也较高。完全性眼球运动障碍可导致眼睛无功能(non-functional eye),影响患者的生存质量。
三叉神经痛可以通过减压术得到好转,但对侵袭Meckel腔及三叉神经的三叉神经痛患者很少会得到好转。剥离(peeling)海绵窦的侧壁也会造成三叉神经损伤。在这些情况下,应考虑和小心避免传入神经阻滞性损害的危险(the risk of deafferentation lesion)。在存在三叉神经一支(V1)功能障碍的情况下,角膜反射的丧失会严重增加角膜炎的风险(risk of keratitis)。对于前岩椎切除术(anterior petrosectomy),较好保留岩大神经(great petrous nerves),以避免干眼综合征。
XI手术并发症
围手术期ICA病变很少发生,但考虑到出血和神经并发症的严重程度,鞍旁脑膜瘤的手术仍是主要的问题。在包绕ICA海的绵窦-斜坡脑膜瘤中,ICA病变的风险较高。在这种情况下,术前血管造影是必要的,而应该讨论球囊试验性阻塞(balloon test occlusion should be discussed)。
对于术中血管病变,修复仍是一个挑战,且修复的长期疗效不能确定,伴有术后假性动脉瘤的风险(图7)。术后通常需要血管造影,并在功能性Willis环的情况下建议闭塞ICA。迟发性假性动脉瘤可采用血管内治疗,但是在早期术后的情况下,血管内手术的可能性是有限的。
假性动脉瘤与双重抗聚集治疗(a double anti-aggregation therapy)的必要性有关。外科对ICA的手术操作和损伤也会增加穿通动脉损伤或栓塞的机制导致卒中的风险。
视力障碍是一种典型的并发症。靠近视神经的钻孔应在显微镜下仔细进行,高冲洗以避免对视神经的热损伤。术后颅神经并发症在前面段落中已加以讨论。
静脉并发症可能是脑膜瘤手术较常见的并发症,可导致水肿和血肿。术前应仔细研究静脉形态。确定作为颞叶的主要静脉引流的Labbe静脉的位置是必要的,这可能影响入路的决定,如后岩椎切除术和乙状窦手术(sigmoid sinus transposition)。
脑膜炎是一种少见的并发症,但早期诊断很重要。在不同情况下,严重和暴发性脑膜炎可导致急剧性的结果。
XII术后评估
术后一天通常需要进行CT和MRI检查。我们建议术后3个月,9个月随访MRI,然后每年进行一次,可以按具体情况调整。EANO小组根据WHO的分级提出建议,WHOI级每年随访,WHOII级一年两次随访。如果病人主诉出现损伤,需要进行术后视力评估。在其他情况下,早期视觉评估是偶发的(facultative)。较重要的视觉评估是在3个月和1年,然后根据不同的情况进行调整。
如果手术位置接近下丘脑和垂体轴,建议在术后一周和术后3个月进行完整的内分泌评估(包括量化摄入量和排出的尿量)。术后部分或完全垂体功能低下和尿崩症(DI)或抗利尿激素分泌异常综合征(SIADH)的发生率各不相同,但仍然很低。然而,内分泌并发症是不可评估的,可能危及生命,对诊断很重要。
XIII.长期随访及结果
结果通常是有利的,但少见的进袭性(aggressive)多次复发的(multirecurrent)患者可能具有挑战性。需要对延迟复发的风险进行长期随访。相比之下,长期的内分泌随访对于正常的术后情况的评估的获益是有限的,除非患者接受过放射治疗(RT)或SRS治疗。
XIV辅助治疗
1.放射治疗和质子束治疗
目前有不同的放射治疗方式来治疗术后的鞍旁脑膜瘤残留。建议系统放射治疗治疗残留的WHO II级脑膜瘤(包括透明细胞脑膜瘤)或具有进袭性特点的WHO I级脑膜瘤。对WHO I级脑膜瘤残留可采取观察。
分割放疗(Fractionted RT)包括常规放射治疗和质子束治疗,仍然是大的和有限的(poor-limited)病变的相关选择。但仍不清楚长期的肿瘤控制和恶性转化的风险。质子束治疗特别适用于鞍旁病变,但不良事件和放射性坏死的发生仍难以评估。不同放射技术的肿瘤复发或进展率相似,但SRS治疗的肿瘤体积退缩率比分割RT高两倍。
2立体定向放射外科(SRS)
SRS主要建议用于海绵窦或Meckel腔的脑膜瘤。肿瘤或术后残留应是小至中等大小,边界局限的(well-limited),远离视神经。在接近视神经通路的情况下,应进行大分割SRS治疗。对于WHO I级鞍旁脑膜瘤,放射外科治疗的结果是有利的,长期复发率也呈现有利,但仍不确定。远端复发的风险是持续的,而肿瘤转化的风险仍然不确定。新发神经麻痹或放射性坏死等并发症很少见。
3.药物治疗
在这个位置的很少需要药物治疗。对于进袭性多次复发的膜瘤,联合应用伊维莫司和奥曲肽作为抗VEGF药物是有意义的。单独的生长抑素(Somatostatine alone)可能与不可切除的颅底生长缓慢的脑膜瘤有关。针对非NF2肿瘤突变的靶向治疗也是一种选择,是对鞍旁脑膜瘤,如病例报道中伴有脑膜上皮亚型和AKT1突变的侵袭性和转移性颅底脑膜瘤。AKT控制剂AZD5363可以控制肿瘤。免疫治疗似乎更适合高级别脑膜瘤。
4.肽受体放射性核素治疗(PRRT)
伴生长抑素的PRRT可作为扩展的颅底脑膜瘤的替代药物治疗(图8)。该疗法的目的是用钇(yttrium)-90-DOTATOC或镥(lutitium)-177-DOTATE等核制剂靶向SST2RA。在大多数脑膜瘤中,SST2RA表达强烈,在脑膜上皮亚型中表达较高。PRRT已经成功应用于胃-胰腺神经内分泌肿瘤的临床实践,这些肿瘤与低级别脑膜瘤的生长模式相似。文献结果对低级别脑膜瘤是有希望的。血液和肾毒性似乎可以接受。PRRT在脑膜瘤中的地位尚不明确,但这些结论表明,在不久的将来,PRRT可能成为低生长率的扩展的颅底脑膜瘤的常规放疗的替代。对于复发性高级别脑膜瘤,文献结果令人失望。
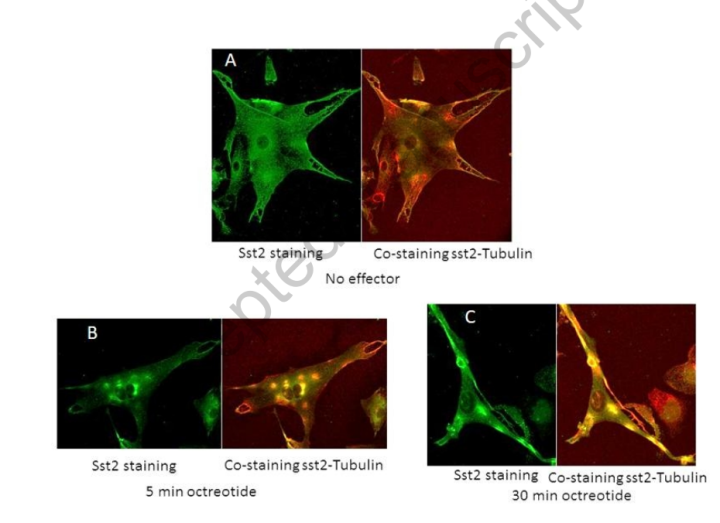
图8:奥曲肽对脑膜瘤细胞中SST2受体内化的体外研究,(来自法国MMG DIP-NET研究组)不含奥曲肽(A,)然后奥曲肽浸渍5分钟后(B)和30分钟(C)的免疫染色研究。
XV与孕酮相关的/孕酮诱发的脑膜瘤:考虑和管理
对每例诊断时应考虑孕酮的摄入,特别是醋酸环丙孕酮(cyproterone acetate)。鞍旁区域是孕激素相关性脑膜瘤的典型部位。根据我们的经验,大约70%的与孕激素相关的脑膜瘤位于颅底前部和颅底内侧。法国国家药品顺利及生产管理局(French agency Agence Nationale de Sécuritédu Médicament et des Produits de Santé)进行了一项法国流行病学研究,将手术或放射治疗脑膜瘤的风险与CPA的摄入量联系起来。结论提示高剂量的CPA摄入与低剂量的CPA摄入相比,脑膜瘤发生的风险增加7倍,当累积剂量超过60g时可达到20倍。需要停用孕酮。只在严重视力损害或有颅内压增高威胁的情况下接受手术。但在大多数情况下,停用孕酮足以提供肿瘤体积减少和临床好转。长期结果似乎有利,但仍不确定,需要长期随访。根据我们的经验,尽管停用CPA治疗,仍观察到有大约5%的患者出现肿瘤生长。
XVI.妊娠和鞍旁脑膜瘤
妊娠期间,鞍旁脑膜瘤是较常见的脑膜瘤部位。这与接近视觉通路的程度有关。高孕酮血浆水平可导致妊娠期脑膜瘤体积增加。这种体积的增加通常是可逆的,而不会严重干扰视觉。因此,如果视力严重受损,应考虑手术切除脑膜瘤。若出现中度视野损伤,可建议在分娩前严密观察,产后再讨论手术决定。每一种情况下的决策都应该是多学科地、逐例进行地,并要符合实施条件。
结论
鞍旁脑膜瘤大多仍属于WHO I级和脑膜上皮亚型的良性肿瘤。应该研究孕酮的摄入量。治疗策略应对应于肿瘤的位置和生长情况。等待-观察(wait and see)可能是一个(好的)选择。内镜是一种可靠的替代传统经颅的入路以诊断海绵窦和Meckel腔脑膜瘤,并对视神经(ON)减压,建议对较佳入路逐例讨论。对于大多数病例,经颅手术仍然是必要的。考虑到经常会不完全切除肿瘤和延迟复发的风险,需要长期随访。放射外科治疗适用于小的、边界局限(well-limited)的脑膜瘤,而放射治疗(RT)和质子束治疗适用于大的、延伸的、不可手术的脑膜瘤。需要定义PPRT的地位。对于少见复发的和进袭性的鞍旁脑膜瘤,应考虑靶向治疗。
资料来源:doi:10.1159/000509090

- 所属栏目:脑膜瘤
- 如想转载“鞍旁脑膜瘤综述:分类、诊断、症状及治疗管理”请务必注明来源和链接。
- 网址:https://www.incsg.com/naomoliu/1378.html
- 更新时间:2021-12-13 17:13:14







