创伤性脑损伤和随后的胶质母细胞瘤发展:文献回顾和病例报告
发布时间:2020-07-31 13:26:33 | 阅读:次| 关键词:
- [案例]脑内血流搭上“直通车”该怎么办?Lawton教授7步拿下胼胝
- [案例]INC国际Rutka教授团队发表成果助力儿童胶质瘤免疫治疗
- [案例]【治疗指南】INC国际福洛里希、Schroeder教授参与欧洲前床
- [案例]得了这种胶质瘤,竟有望通过全切手术治愈!
- [案例]对抗婴儿痉挛引发的癫痫治疗案例
- [案例]6岁男孩脑干胶质瘤 “巴爷爷”成功手术后都可以包水饺啦
胶质母细胞瘤(GBM)是常见和较致命的脑恶性肿瘤,在美国每年有超过10000例新病例,手术切除和同步放化疗后中位生存只有14-16个月。在少数病例中,胶质瘤或GBM是在肿瘤控制基因的种系突变引起的特定遗传条件下发生的,即神经纤维瘤病1(NF1)、结节性硬化症(TSC)和Li-Fraumeni综合征(TP53)。一种少见的遗传性疾病叫做脂肪肝,它是由编码异柠檬酸脱氢酶(IDH1)的基因功能获得突变的嵌合现象引起的,它增加了形成胶质瘤和内生软骨瘤的风险。家族病史也与GBM风险增加有关。较近的全基因组关联研究(GWAS)指出,单核苷酸多态性(SNPs)增加了胶质瘤发生的可能性。值得注意的是,该SNP位于染色体8q24.21,位于名为CCDC26的长链非编码RNA(lncRNA)的位点上,使胶质瘤风险增加约5倍。然而,遗传和环境因素在胶质发育中的作用尚不清楚。
除暴露于电离辐射外,GBM的环境危险因素仍然没有明确的定义。在这里,我们讨论一个不太为人所知的假定的神经胶质发育危险因素,创伤性脑损伤(TBI)。在少见的情况下,GBM的形成已经被记录在以前受损伤的大脑区域。在描述TBI和GBM之间关系的有限文献中,建立了以下标准来暗示二者之间的因果关系:
1、损伤需严重到足以引起组织修复过程的开始;
2、外伤性损伤的区域应与随后的GBM的位置直接对应;
3、在脑损伤和肿瘤出现之间应该有至少一年的间隔。较长的潜伏期被认为是因果关系的更有力证据。
在这里,我们介绍了两位在几年前遭受脑外伤的同一部位发生GBM的病人。我们还回顾了相关的流行病学研究,这些研究对于TBI和GBM之间的关系总体上是模棱两可的。较后,我们提出了一种机制,可以解释TBI和胶质发育之间的生物学联系,通过调用炎症来触发神经干和祖细胞的癌化转化,这些细胞迁移到损伤组织进行修复。慢性炎症已被证明是许多实体肿瘤的主要诱发因素,包括但不限于肝细胞癌和结肠癌。然而,由于大脑独特的免疫特性,这种联系还没有在胶质发育中被探索。我们假设,在一部分患者中,创伤后大脑炎症可能使神经细胞倾向于致癌转化和胶质瘤的发生。
材料和方法
我们在PubMed上进行了文献检索,以确定研究脑损伤和GBM形成之间联系的流行病学研究。我们还收集和分析了两位有TBI病史的患者的临床和影像学资料,他们后来发展为GBM。
结果
流行病学研究
一些流行病学研究试图分析GBM的形成和以前的TBI的存在之间的关系。这些研究对于TBI诱导的GBM的相关强度和优势比呈现出不同的结果。尼格伦等人在瑞典进行了一项基于人群的队列研究,分析了超过30万名记录在案的1965年至1994年间遭受创伤性脑损伤的患者。总共发现了400例脑瘤。四分之一的病例被排除,因为他们发生在创伤性脑损伤后的一年。这项大型研究发现脑外伤后脑瘤形成的风险没有增加。丹麦的一个类似队列显示,TBI后脑瘤发生的风险略有升高,尽管该研究的随访时间很短。较近一项对丹麦40多万名患者进行的大规模队列分析发现,在受伤后的头4年里,脑损伤和恶性胶质瘤风险之间没有关联。有趣的是,同一项研究还发现,脑损伤与恶性胶质瘤的长期保护有关。
一个台湾省研究小组分析了在2001年至2002年间到流动医疗中心就诊的5007名患者。本研究发现,有TBI病史的患者恶性脑瘤发病率为6.28/10000人年,而对照组为1.25/10000人年。TBI患者在3年内发生颅内恶性肿瘤的优势比非TBI患者高4.67倍。作者还报告了脑外伤严重程度和脑瘤发展之间具有统计学意义的相关性。
Gurney等人进行了一项多中心病例对照研究,具体分析了儿童脑损伤与肿瘤形成之间的关系。在一组801名儿童中,由于之前的TBI而发展成原发性脑瘤的优势比为1.4。年龄、性别和研究地点的校正没有改变优势比。然而,有人指出,亚组内的某些变量与较高的优势比有关。例如,出生时受伤并随后头部受伤的儿童的比值比为2.6,而使用产钳分娩并随后发生TBI的儿童的比值比为2.1。这一发现可能暗示了多处脑损伤(婴儿时期的脑损伤在以后的生活中又发生了一次TBI)可能比单一的脑损伤更有可能产生原发性肿瘤。失去意识的儿童的优势比增加到1.6,而在整个研究中是1.4。这种增加的优势比可能表明损伤的严重程度可能与发展为肿瘤的风险相关。我们推测,这种相关性可能是由于损伤越严重,炎症就越严重。
一项由Preston-Martin等人完成的研究发现,头部损伤导致的意识丧失或长期性疤痕的比值比为1.9,这可能为脑损伤的严重程度与随后的肿瘤发展之间的联系提供了一些证据。Monteiro等人发现,TBI患者发生脑瘤的倾向增加(OR=1.49)。这项研究还发现,两次或两次以上的脑损伤会导致更高的优势比(3.14;根据年龄、性别和教育程度调整),支持了损伤的严重程度和频率与随后肿瘤形成之间的联系。
相关案例一则
患者54岁,右利手,47岁,在一次车祸中右额叶下端严重挫伤[图1]。受伤后不久,他患上了创伤后脑积水,并接受了右额脑室-腹腔分流术的治疗。随后,他需要放置心脏起搏器,这就妨碍了MRI成像。随后对他进行连续的计算机断层扫描(CT),显示挫伤的清晰度和右下额部脑软化的发展。
受伤七年后,他因头痛和神志不清再次接受治疗。CT显示在脑损伤部位有一个4厘米的异位增强的右下额部肿块。病变周围有广泛的血管源性水肿。他接受了右额叶开颅手术,以完全切除肿块,诊断为GBM。IDH1 R132H突变的免疫组化结果为阴性。随后根据Stupp协议对其进行了放化疗。术后8个月的较新随访显示,其神经系统完好,CT没有复发迹象。
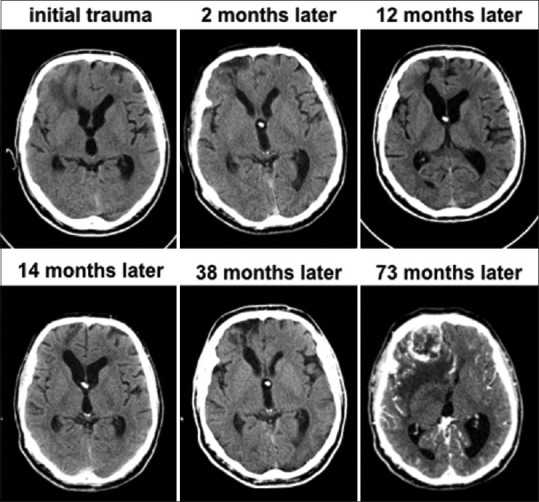
图1:连续73个月的电脑断层扫描显示右下额叶的胶质母细胞瘤在挫伤部位发生。全部的图像都没有对比,除了较后一个
讨论:胶质瘤和脑损伤是否有关系呢?
流行病学研究在很大水平上对TBI病和恶性神经胶质瘤的形成之间的联系含糊不清。事实上,大规模的研究表明没有相关性。然而,上面的病例显示在先前脑损伤的部位形成了GBM。我们的假设是,在一些患者中,潜在的生物脆弱性使他们在脑外伤后易患胶质细胞瘤。可能解释损伤驱动的胶质细胞瘤的机制是什么?
我们认为,创伤性脑损伤后的炎症反应与神经干细胞和祖细胞的致癌转化有关,这些神经干细胞和祖细胞在炎症反应下以化学方式迁移到损伤部位[图2]。损伤、炎症和癌症之间的联系已经在其他器官系统中牢固地建立起来。例如,肝炎和胰腺炎的强烈炎症反应分别是肝细胞癌和胰腺癌发展的严重危险因素。因此,类似的过程可能是脑损伤驱动的神经胶质发育的基础。
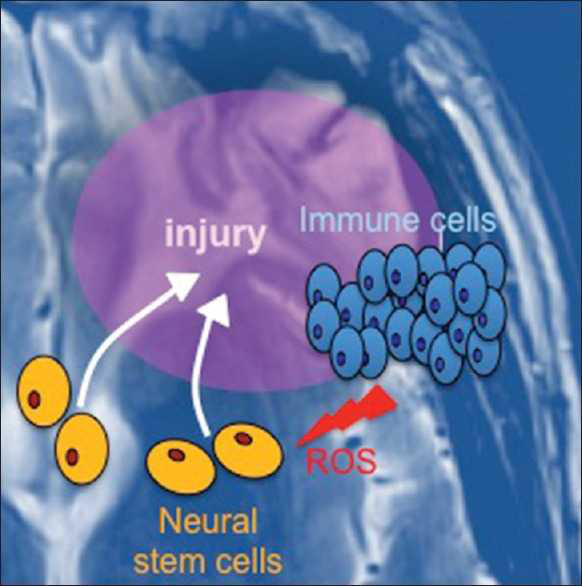
图2:外伤性脑损伤与胶质母细胞瘤形成的联系模型。当大脑受到损伤时,神经干细胞会迁移到该部位,使组织得以修复。与此同时,免疫细胞被招募进来。免疫细胞释放活性氧(ROS),可诱导干细胞的诱变和促癌转化
炎症
在急性创伤后时期,驻留的脑小胶质细胞和髓样炎性细胞被相继动员到损伤部位。外周嗜中性粒细胞、单核细胞和嗜酸性粒细胞在数小时内被募集到该部位,并可保持较长时间。这些炎性细胞可通过产生具有诱变特性的活性氧(ROS)或通过分泌对神经干细胞和祖细胞具有促有丝分裂作用的生长因子和细胞因子,以及延长炎症反应来促进肿瘤发生。例如,嗜酸性粒细胞与格林巴利综合征的发生和发展有关。嗜酸性颗粒物质已被证明会对组织造成损害,这种效应被称为戈登现象。嗜酸性粒细胞衍生神经毒素(EDN)、嗜酸性粒细胞阳离子蛋白和嗜酸性粒细胞蛋白X(EPX)已被实验证明在脱颗粒过程中对神经组织产生细胞损伤。此外,嗜酸性粒细胞过氧化物酶产生活性氧,这可能导致诱变。
许多炎症细胞因子,包括IL-1、TNF、IL-10、IL-6、IL-8和MCP-1,已知在TBI中上调,促进骨髓免疫细胞的募集。此外,研究表明,白介素-4受体和白介素-13的单核苷酸多态性(SNPs)可能是GBM形成的危险因素。IL-4和IL-13细胞因子都能激活免疫系统细胞上的IL-4R的IL-4R受体,导致类似的下游反应,较终导致趋化因子如趋化因子和单核细胞趋化蛋白-1的释放。这些趋化因子导致嗜酸性粒细胞和单核细胞迁移到受损区域。
干细胞向损伤部位迁移
成人大脑中的神经干细胞主要定位于两个神经原性区域,即侧脑室的室下区和海马齿状回的粒下区。也有推测认为神经干或祖细胞可能驻留在皮层区域,然而,这是有争议的。神经源性龛中的神经干细胞产生的谱系遍布大脑:神经元、星形胶质细胞和少突胶质细胞。神经干细胞和后代祖细胞化学迁移到脑损伤部位,参与脑损伤的修复和恢复。室管膜细胞排列在心室的内壁上,在小鼠和人类受到创伤后,也可能增殖并分化成神经母细胞和星形胶质细胞。这种化学吸引介导的迁移已在各种产生伤害的损伤中得到证实,即缺血、脱髓鞘,以及对我们来说重要的物理创伤。因此,当神经干细胞或祖细胞迁移到损伤处以修复组织损伤时,它们的转化可能会导致GBM。
神经干细胞的致癌潜能是通过观察大脑中的神经源性龛位对化学致癌作用敏感而提出的。涉及神经干细胞中癌基因的过表达和肿瘤控制基因的失活的实验模型表明,它们可以产生GBM。GBM经常出现在脑室周围区或与脑室下区直接接触的事实支持了这一假设。小鼠的遗传模型提高了少突胶质细胞祖细胞可能也是GBM中假定的细胞起源的可能性。其他研究表明,即使是晚期分化的脑细胞,如神经元和星形胶质细胞,也可以通过基因改变驱动的去分化而产生GBM。此外,刺伤附近的星形胶质细胞在其谱系中增殖体内然而,来自受损脑组织的一小部分星形胶质细胞显示出长期干细胞样活性在试管内神经球测定,表明在某些条件下有可能恢复多潜能。总的来说,这些观察结果表明迁移到创伤性脑损伤部位的几种神经细胞类型能够发生致癌转化。
结论
总之,大规模流行病学研究并没有显示TBI和GBM发生风险增加之间的明确联系。然而,案例中病人在几年后在他们的脑损伤部位发生GBM。因此,在一部分脑损伤患者中,潜在的生物脆弱性可能使他们倾向于神经胶质发育。我们提出了一个假定的模型,将神经炎症与神经干细胞和神经祖细胞迁移到损伤部位的突变联系起来,导致它们的肿瘤转化和胶质瘤的发生。在未来,随着胶质细胞瘤形成的分子机制和大脑对TBI的反应变得更加清晰,我们希望能够确定使一部分患者在受伤后易于形成脑瘤的生物学机制。
资料来源:Vineet Tyagi,Jason Theobald,James Barger,Mark Bustoros,N.Sumru Bayin,Aram S.Modrek,Michael Kader,Erich G.Anderer,Bernadine Donahue,Girish Fatterpekar,and Dimitris G Placantonakis.Traumatic brain injury and subsequent glioblastoma development:Review of the literature and case reports.Published online 2016 Aug 26.doi:10.4103/2152-7806.189296

- 所属栏目:胶质瘤
- 如想转载“创伤性脑损伤和随后的胶质母细胞瘤发展:文献回顾和病例报告”请务必注明来源和链接。
- 网址:https://www.incsg.com/jiaozhiliu/415.html
- 更新时间:2020-07-31 13:23:36







