【胶质瘤能治好吗】胶质母细胞瘤长期生存的预后因素有哪些?
发布时间:2020-07-06 13:23:18 | 阅读:次| 关键词:
- [案例]原本瘫痪的25岁女孩,手术全切脑干海绵状血管瘤后,重新
- [案例]风险大、手术难、预后不明?INC神外教授远程咨询,为疑
- [案例]“真的有幸了解到巴教授!”疑难胶质瘤女孩成功示范手
- [案例]【福医妙手】INC国际教授福洛里希脑膜瘤案例九|70岁,岩
- [案例]解析国际研究:脊索瘤治疗,手术与质子疗法,何为优选
- [案例]下丘脑错构瘤致性早熟、“痴笑性”癫痫,这种“黑科技
胶质母细胞瘤(GBM)的长期幸存者很少。除了肿瘤的大小和位置外,还有几个变量决定了患者的生存机会:诊断时的年龄,年轻的患者通常接受更的多模式治疗;功能状态与年龄呈负相关;以及组织学和遗传学标记。
在美国每年诊断出的17000个原发性脑肿瘤中,大约60%是神经胶质瘤。胶质母细胞瘤(GBM),或IV级星形细胞瘤,是目前无法治愈的较具侵袭性的原发性脑肿瘤。治疗仍然是姑息性的,包括手术、放疗和化疗。在较佳治疗下,GBMs患者的中位生存期小于一年。大约2%的病人存活三年。先前报道的GBM的长期存活者(LTSs)可能是实际上患有其他低级别胶质瘤的患者。自20世纪80年代以来,尽管在神经成像、神经外科、放疗和化疗技术方面取得了进展,GBM的总体预后变化不大。
我们发现患者的存活取决于以下临床和生物学参数:肿瘤大小和位置、治疗、发病年龄、发病时的卡氏表现评分(KPS)、组织学表现和分子遗传因素。
胶质母细胞瘤长期生存的预后因素之肿瘤大小及位置
GBM是一种浸润性很强的肿瘤,大部分不能完全切除;因此,外科手术通常包括不完全的去切除。手术切除的可行性和范围取决于肿瘤的大小和位置。幕上和小脑肿瘤较脑干或间脑肿瘤更易于手术治疗,因此具有更好的生存期。
胶质母细胞瘤长期生存的预后因素之选择的治疗方案
临床证据表明,和多模式的治疗可以延长生存期。全切除或不全切除联合放化疗是治疗的主要方法。仍在研究中的新疗法已显示出一些有希望的结果。
巴特朗菲教授实施手术病例一则:
胶质母细胞瘤术前术后对比一例(国内、美国均无法手术)
患者:女,25岁
临床诊断:1.右顶枕、右丘脑及中脑室管膜瘤。
2.梗阻性脑积水,左侧脑室外引流术后。
3.继发性癫痫持续发作(浅昏迷)。
手术医生:德国INI神经外科教授Bertalanffy教授(巴特朗菲教授)
病史:2016年9月29日包机前往美国MD安德森医院,发现患者已明显梗阻性脑积水,予行脑室外引流术,考虑无法切除肿瘤,建议患者放弃治疗。患者迅速进入昏迷状态,持续住重症ICU病房。右侧丘脑和中脑的肿瘤位置深,周围结构复杂,手术风险高,国内目前对于这类肿瘤没有一个很好的解决办法,一般多采取保守治疗,这样对于胶质母细胞瘤这种恶性程度较高,发展迅速的肿瘤来说,不是一个好的选择,如果冒着较大风险实施手术容易造成很多昏迷、瘫痪等严重的并发症,术后生存时间不长、生活质量不高,容易复发。
体征:明显嗜睡状,左肢体腱反射亢进,左侧肢体肌力2级。对答欠切题。
2016年10月8日,患者包机至德国(INI Hannover)。10月10日Bertalanffy教授给予行肿瘤切除术。
术前影像:(2016.10.10)MRI:右侧丘脑、右侧中脑、右顶枕肿瘤占位,边界欠清晰,周围脑组织水肿明显,大脑中线向左侧偏移明显。
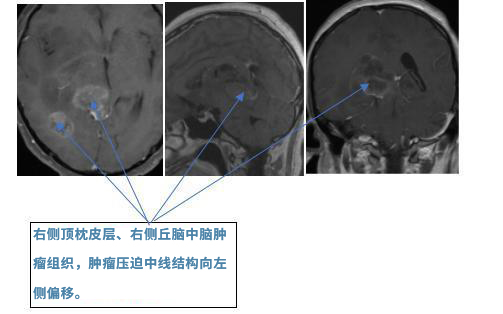
手术过程:2016.10.10术中磁共振手术室,患者俯卧位,取右侧枕顶骨瓣,导航引导下切除右枕顶皮层下肿瘤,并进入深部切除右侧丘脑及中脑肿瘤。术中功能磁共振复查,肿瘤全切除。2016.10.16拔除脑室外引流管(美国MD安德森医院留置)。患者无颅高压症状,无再发脑积水,无再发癫痫。
术后影像:(2016.10.15)MRI:右侧丘脑、右侧中脑、右顶枕肿瘤占位全切除,中线偏移有好转。
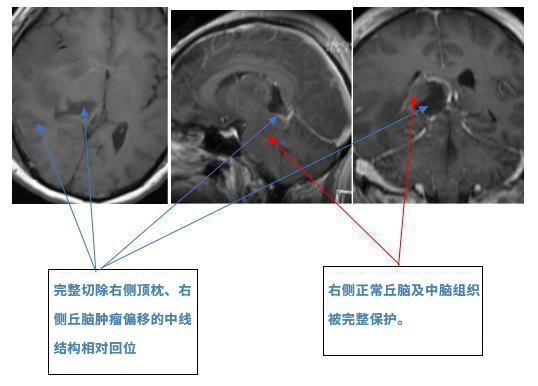
术后情况:术后一天患者清醒,可用英语正常对答(患者早年留学美国)。术后ICU观察二天,术后一周可家属两人掺扶下床进行康复锻炼。术后一个月,自行步行出院,左侧肢体肌力5-级,左下肢仍可见跛行状,左上肢细致活动仍较差,但已可持筷夹取食物。未再有癫痫发作。
总结:这例患者胶质瘤的位置位于右侧顶枕叶、右侧丘脑并向下累及中脑。肿瘤压迫正常脑实质,造成了患者脑实质中线结构的偏移。大脑皮层是分布着我们的人体的听、说、读、写、记忆、感情等重要功能区,丘脑也是体温、内分泌、呼吸调节等重要中枢。在手术过程中能否较好的保护这些正常的脑组织结构,对术后的预后和恢复起着至关重要的作用。这例由德国INI教授巴特朗菲教授操刀的胶质母细胞肿瘤,凭借着巧夺天工的手法和丰富肿瘤切除经验为患者实施了的肿瘤全切术,是瘤体的切除以及正常丘脑和中脑的完整保护,对预防后期肿瘤的复发以及功能的保护起到了较大的作用,也展示了教授本人的风采。
胶质母细胞瘤长期生存的预后因素之年龄大小
几乎全部的研究都显示,年龄的增长与术后生存时间呈的负相关。在Korshunov等人2005年的一份研究报告中,年龄在40岁以下、存活5年以上的患者占34%,而40岁及以上患者占6%。研究人员建议,40岁是根据预后将GBM患者分组的较佳年龄。
胶质母细胞瘤长期生存的预后因素之卡氏评分
许多研究结果表明,较高的KPS与好转的结果相关。这很可能与诊断时年龄偏小有关。
肿瘤的大小和位置、治疗方法、出现时的年龄和出现时的KPS可将患者分为危险组。Lamborn等人利用递归分区分析确定了四个风险组。两组较低的风险组包括年龄小于40岁的患者,较低的风险组是仅在额叶有肿瘤的年轻患者。中等危险组包括KPS>70、小全切除或全切除患者,年龄在40岁至65岁之间。高危人群包括65岁以上、40-65岁KPS<80或仅活检的患者。亚组分析显示,纳入辅助化疗可提高生存率,但对于65岁以上、KPS<80岁、40岁以上和接受近距离放射治疗的患者,这种好转往往微乎其微。
的多模态治疗能延长患者的生存期,组织学研究
肿瘤等级越高,恶性程度越高,预后越差。肿瘤的分级主要依据其增殖指数,增殖指数是GBM中一个重要的预后因子。Ki-67蛋白在细胞周期中除G0外的全部阶段均有表达,是细胞增殖的良好标记物。Ki-67免疫组织化学在GBM中评价增殖指数的研究表明,高增殖率与较短的无病期和总生存率之间存在相关性。
胶质母细胞瘤的细胞学和组织学组成对生存有影响。微囊性改变、星形胶质细胞分化明显的细胞(纤维星形胶质细胞)的存在,以及存在分化较好的区域的主观印象与较好的结果相关。另一种组织学因素钙化在一项研究中与更好的预后有关。坏死的存在与不良预后之间也存在关系。Korshunov等人发现,一些对预后具有重要意义的组织学和遗传学标记物似乎与单个细胞亚群的生物学特性密切相关(见“分子遗传因子”),因此他们将GBM分为三个细胞亚群:小细胞GBM(SGBM)、多形细胞GBM(PGBM)和芽生细胞GBM(GGBM)。
胶质母细胞瘤长期生存的预后因素之分子遗传因素
GBM的细胞遗传学和分子遗传学研究表明,这些肿瘤中常见的改变是染色体臂10q(60%-90%)的杂合性缺失,p53(25%-40%)的突变,PTEN突变(30%),MDM2过表达(10%-15%),表皮生长因子受体(EGFR)基因扩增。长期存活者LTSs(>3年)中p53表达增加1个,短期存活者(<3年)中MDM2表达过度。Korshunov等人发现p53阳性肿瘤在PGBM中占多数,而EGFR和MDM2阳性肿瘤在SGBM中明显增多。GGBM中增殖细胞核抗原(PCNA)标记指数(LI)均值较低,p21ras阳性例数较多,平均凋亡指数(AI)较高。因此,在组织学和遗传标记之间存在着联系。SGBM、EGFR、MDM2阳性、PCNA LI>40%患者的生存时间明显缩短,而p21ras和AI>0.5%的存在与延长生存时间有关。在另一项研究中,Korshunov等人发现40岁以下与良好的预后密切相关。EGFR扩增、9p21缺失和9号染色体扩增对全部患者均具有预后意义,而7号染色体扩增和10q23/PTEN缺失仅对40岁以上患者具有临床意义。Krex等人研究了55名超过3年的GBM患者。他们发现LTSs中o6-甲基鸟嘌呤-dna甲基转移酶(MGMT)高甲基化的频率明显更高。有趣的是,MGMT基因06烷基鸟嘌呤-dna烷基转移酶的蛋白产物被证明与肿瘤对烷基化剂的耐药有关。启动子甲基化对MGMT基因的沉默损害了DNA修复,并与使用烷基化剂的胶质母细胞瘤患者的更长的生存期有关。目前,恶性胶质瘤的临床试验通常包括测定MGMT表达状态。
结论
GBMS是一种高度恶性的肿瘤,很难(但并非不可能)根除,且预后不良。幸存者是少见的。除了肿瘤的大小和位置外,还有几个因素决定了GBM诊断后患者的生存机会。年龄和功能状态是两个重要的预后方面,似乎是相关的。增殖指数和遗传标记也与年龄有关。此外,年轻患者通常接受的多模式治疗。因此,诊断年龄在GBM患者预后中起着关键作用。

- 所属栏目:胶质瘤
- 如想转载“【胶质瘤能治好吗】胶质母细胞瘤长期生存的预后因素有哪些?”请务必注明来源和链接。
- 网址:https://www.incsg.com/jiaozhiliu/374.html
- 更新时间:2020-07-06 13:20:24
- 上一篇:儿童高级别胶质瘤的外科治疗及预后
- 下一篇:胶质瘤是怎样形成的?胶质瘤遗传吗?







