丘脑胶母GBM生存期可有多久?两则案例肿瘤切除>80%时,生存期达4年余
发布时间:2021-12-21 15:53:55 | 阅读:次| 关键词:
- [案例]25岁瘫痪女孩手术全切脑干海绵状血管瘤案例
- [案例]良性脑瘤预后却“不良”?INC国际四大颅咽管瘤专家:如
- [案例]脑海绵状血管瘤急性出血期的抉择:「回家静养」还是「
- [案例]13岁女孩如何“斗赢”5cm巨大髓母细胞瘤?Rutka教授术后
- [案例]功能性垂体瘤—泌乳素瘤可以不手术吗?INC国际大咖施罗
- [案例]儿童反复头痛、还可能智力下降!脑血管病-烟雾病的“无
什么是丘脑?丘脑又称背侧丘脑,是间脑中较大的卵圆形灰质核团,位于三脑室的两侧,左、右丘脑借灰质团块(称中间块)相连。丘脑位置深在、靠近功能区,有许多重要的神经核团,加上其本身及周围结构重要、复杂,丘脑位置的手术有肢体瘫痪、感觉障碍等风险大。由于位置深在且毗邻重要功能区,丘脑肿瘤手术切除一直是神经外科的难题。
欧洲、美国以及中国新版的治疗规范都指出,治疗脑肿瘤,手术是优选和基本的治疗方案,应寻求适合的较佳手术入路,保障一次手术全切。手术在保护好周围正常脑组织的同时,切除率越大,患者长期生存的可能性越高。对于胶质母细胞瘤也是如此,已有很多研究证实了较大水平的手术切除在治疗胶质母细胞瘤中的重要性,然而,丘脑胶质母细胞瘤的较大切除却很少尝试,其作用仍不清楚。在传统丘脑胶质母细胞瘤的治疗中,经常进行活检以确认病理诊断和分子特征,而手术切除仍然具有挑战性。
2021年2月新近发表的论文《Maximal surgical resection and adjuvant surgical technique to prolong the survival of adult patients with thalamic glioblastoma》中通过临床研究以及真实案例证明了较大水平手术切除在成人丘脑胶质母细胞瘤(GBM)治疗中的作用,并确定较大顺利切除的手术技术所产生的影响。

论文截图
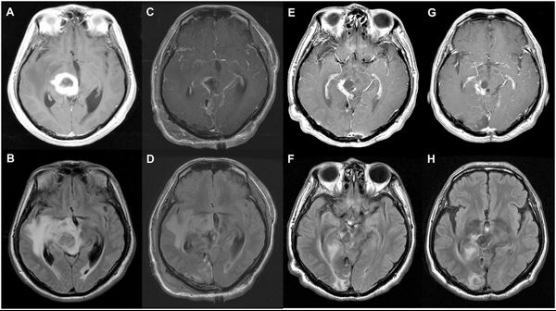
案例一:68岁男士丘脑GBM获次全切,术后4年多未复发
一名68岁男性因头痛和视力模糊入院。术前磁共振成像(MRI)显示外侧丘脑病变中的囊性和实性肿块,增强强化,提示胶质瘤。术后MRI显示肿瘤大体切除(C)、肿瘤次全切除(D)。在一年的随访MRI中,T1增强图像(E)中有不规则和模糊的增强,T2-FLAIR图像(F)中有高信号。在2年的随访MRI中,T1对比增强图像(G)和T2-FLAIR图像(H)处于稳定状态。患者健在,术后生存时间为1515天。
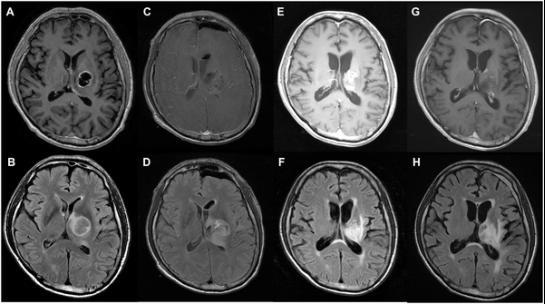
案例2:52岁丘脑GBM女士,次全切后4年未复发,生活如常
一名52岁女性,因神志不清、复视、运动无力入院。术前磁共振成像(MRI)显示:下丘脑病变中的囊性和实性肿块。术后MRI显示T1增强图像上的肿瘤次全切除(C、D)。在一年的随访MRI中,T1-对比增强图像(E)有不规则增强,T2-FLAIR图像(F)有高信号。在2年的随访MRI中,T1增强(G)和T2-FLAIR图像(H)显示稳定状态。患者健在,术后生存时间为1469天。
治疗策略
在怀疑丘脑胶质母细胞瘤的情况下,手术切除一般是优选治疗方法。如果可能,手术的目的是保留神经功能前提下全切除。在预期出现严重神经系统并发症、怀疑皮质脊髓束(CST)损伤或可能发生脑干损伤或血管损伤的情况下进行次全切除。活检是心室壁强化、软脑膜强化或远处多发强化病变患者的治疗选择。病理诊断确诊后,本研究全部患者均接受胶质母细胞瘤标准治疗(同步放化疗和替莫唑胺化疗)
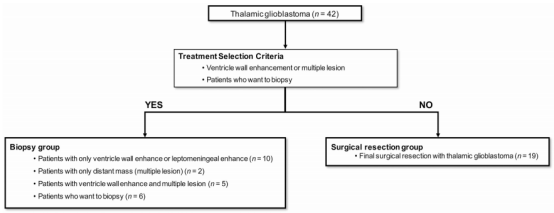
丘脑GBM的治疗策略和患者选择。对于疑似丘脑胶质母细胞瘤,手术切除是优选治疗方法。当心室壁强化、软脑膜强化或远距离多发强化病灶时,考虑只活检手术。
辅助手术技术
术前导航MRI、弥散张量纤维束成像(DTI)、增强型计算机断层(CT)常规进行并融合在一起。在硬脑膜完全打开之前,导航棒通过小硬脑膜切口(<5 mm)的切口插入肿瘤靶标,其主要目标区域是皮质脊髓束和中脑,在手术过程中难以区分。在融合图像中标记了靶标插入的目标点。在手术过程中,使用这些靶标,能在显微镜下确认目标病变并将融合图像与目标点进行比较。由于手术过程中肿瘤体积缩小,肿瘤及其周围环境发生了改变;因此,术中进行CT以识别病灶相对于融合图像的变化。5-ALA用于区分全部手术切除病例中的肿瘤病变。经颅运动诱发电位(MEP)和单较直接皮层下刺激(DSS)用于确认术中功能状态和CST的位置。在整个皮层手术过程中,每5分钟以60~100mA监测经颅MEP。DSS以10 mA启动,并随着刺激器接近CST而降低至6mA。如果患者状态允许,则在患者清醒时进行清醒手术,以检查患者术中功能状态。
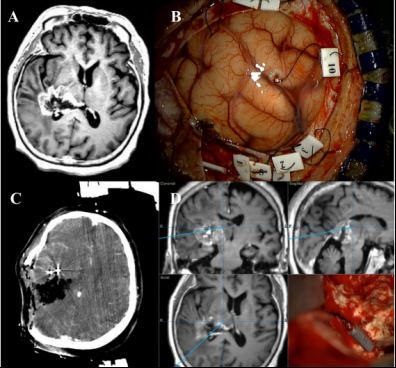
术中导航辅助手术技术:右后部胶质母细胞瘤的术前磁共振图像,侧向伸展的丘脑(A)。导航帮插入目标区域(B)。在操作过程中,术中计算机断层扫描图像和尾弹技术用于调整大脑转移和确认目标病变(C,D)。
手术入路
手术入路的选择是根据肿瘤中心的位置和相邻的皮质脊髓束。考虑到肿瘤侵犯的模式和形态方式和CST的位置,建议选择从皮质到肿瘤的较短手术通道。当肿瘤位于丘脑前外侧或后外侧并向上外侧方向延伸时,选择经皮质入路。当肿瘤位于后外侧丘脑时,选择经皮层-经脑室入路。当肿瘤位于丘脑内侧和后部时,选择了半球间经胼胝体入路,而外侧丘脑病变则选择了经外侧裂-经岛叶入路。对于丘脑后下部和内侧后下部病变,采用枕部经小脑幕入路。改良的外侧眶上(MLSO)入路用于治疗前丘脑肿瘤。
临床结果
为了评估手术切除与活检相比的临床疗效,有研究者们估计了三组之间总生存期(OS)和无进展生存期(PFS)的差异:手术切除(n=19)、医生选择的活检(n=17)和患者选择的活检(n=6)。手术切除组显示出良好的OS(中位数:676天,p=0.001)(下图A)和PFS(中位数:328天,p=0.001)(下图B)与所述活检组(医生选择活组织检查,位OS相比:240天,中位PFS:134天;选择活检的患者,中位OS:212天,中位PFS:118天)
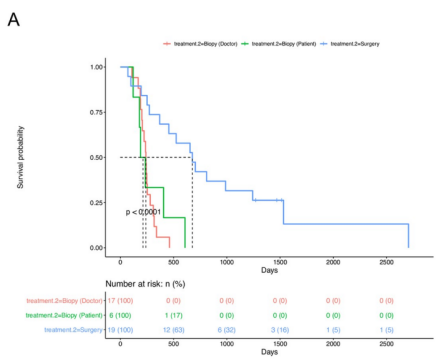
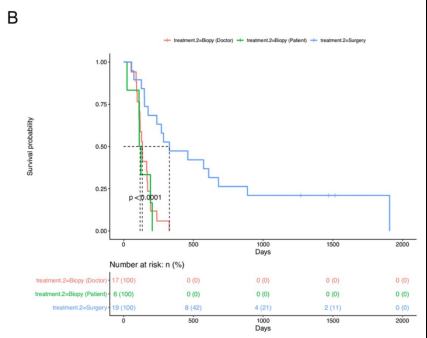
手术切除和活检组的生存分析。A.接受手术的患者的总生存期(OS)更长,与根据治疗标准接受活检的患者(医生选择活检组)或选择活检的患者(患者选择活检组)相比,切除组p<0.001。B.手术切除组的无进展生存期(PFS)明显长于选择活检组的医生或患者选择活检组(p<0.001)。
此外,研究专家还表示,手术切除组与活检组在运动相关的神经系统并发症如运动无力、感觉障碍、视力障碍、认知恶化和KPS恶化方面无差异,当然该研究有的中心差异性,且案例数较少。
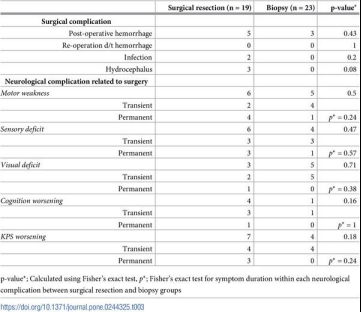
手术切除组和活检组之间手术和神经系统并发症的分布图
较后,研究得出结论,对于丘脑胶质母细胞瘤患者,选择合适的手术切除很重要。如果没有增强病灶或没有多发病灶,当较大手术切除率超过80%时,可以预期比单独活检有更长的生存期。使用一些高科技术中神经外科辅助设备可有助于更准确地切除肿瘤,且降低手术并发症发病率,通过仔细监测如MEP和DSS来检查神经生理状态很重要。
高科技神外手术辅助设备都有哪些?
设备好和手术得好、手术效果好有着密不可分的关系,设备的革新造福的将是更多的神经外科脑瘤疾病患者。随着神经外科手术技术的发展,一些术中辅助设备的进步与发展大大提高了手术切除的准确性和顺利性。
1、手术室中的“航空母舰”——磁共振复合手术室:主要设备为术中磁共振成像系统(intraoperative MRI,简称iMRI),起着大脑“手术地图”的关键作用,它能够在手术过程中的任何时刻确定大脑内肿瘤的准确位置,使术中“实时”(real-time)成像成为可能,从而为神经外科医生提供了实时更新的脑部GPS影像地图。

德国INI磁共振复合手术室
2、大脑里的“GPS系统”——术中神经功能导航:同汽车导航一样,在脑肿瘤手术中导航系统也是有用的。因为能够实时知道脑肿瘤的具体位置,手术医生可以判断到重要的脑功能区和神经纤维的距离有多远,能顺利地切除到哪里。
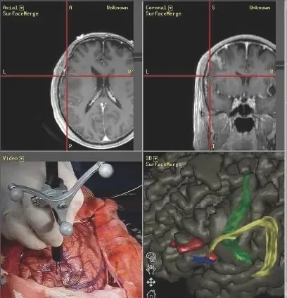
术中神经导航系统所显示的影像
3、实时监控大脑神经——术中神经电生理监测:电生理用于反映患者术中的神经系统功能状态,通常依靠术中神经电生理监测来指导外科手术操作,并且在术中预防神经组织发生缺血或损伤。
术中神经电生理检测设备
4、实时术中成像解决方案——术中超声导航:可显示脑移位术中超声导航进一步完善了颅脑影像引导的手术系统,占地面积小,几乎适用于全部神经外科手术室。叠加到术前患者数据上的实时超声影像可实现对脑移位的显示和评估。
参考文献:https://doi.org/10.1371/journal.pone.0244325

- 所属栏目:胶质瘤
- 如想转载“丘脑胶母GBM生存期可有多久?两则案例肿瘤切除>80%时,生存期达4年余”请务必注明来源和链接。
- 网址:https://www.incsg.com/jiaozhiliu/1406.html
- 更新时间:2021-12-21 17:02:58







